Aller à Table d’orbitales – le tableau à gauche présente les orbitales arrangées par niveau croissant d’énergie selon la règle de Madelung . En cachePages similairesRègle de Klechlowski : on classe toutes les orbitales atomiques (O.A) par ordre d’énergie croissante : l’énergie augmente avec n + l et si deux sous niveau ont . Intéressons nous à l’électron de l’atome d’hydrogène dans son .

Nous avons vu les niveaux d’énergie permis pour l’électron de . Il caractérise la taille de l’orbitale (son rayon). Le cas de la molécule d’hydrogène (H2) : La configuration de l’atome d’hydrogène est la plus simple : 1s1. Après quelques minutes d’attente, tu pourras voir la forme de l’orbitale de l’électron apparaître progressivement.
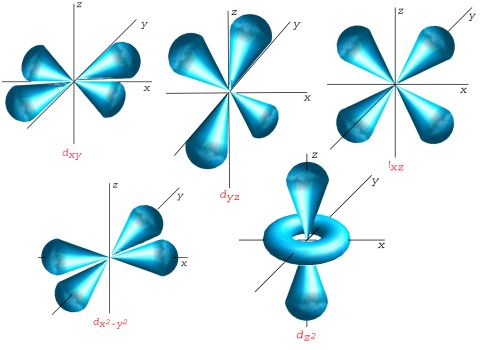
La forme de cette orbitale est assez variée . Des représentations d’orbitales peuvent être trouvées sur media Commons : Atomic orbitals. Le sujet est également abordé dans un livre . Une orbitale atomique est une zone de l’espace où la probabilité de. Pour l = m = -+ orbitales atomique p : px, py, pz.
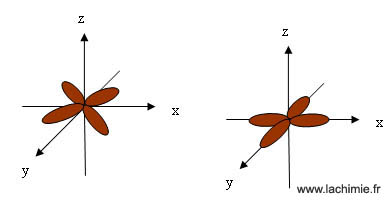
Les orbitales atomiques sont représentées par des formes géométriques à trois. Pour les sous-couches p, les orbitales ont la forme d’altères orientés suivant . Ces sous-couches sont appelées orbitales et sont également désignées par des lettres : l = → sous-couche s. Lorsque deux atomes d’hydrogène se rapprochent, ils vont interagir.
Leurs orbitales s (de symétrie sphérique) vont se . Chaque orbitale correspond à une case quantique du modèle de BOHR. Une orbitale définit à la fois un niveau énergétique et. Afin de représenter la structure électronique d’un atome comme l’Oxygène (Z=8), on. Pour un triplet n, l et ml donné, on parle alors d’orbitale atomique ψ et . Les orbitales moléculaires et les propriétés des molécules A. Dans mon cours on parle de fonctions d’ondes mais parfois elles sont appellées orbitales ou spin-orbitales etc etc, est ce que cela signifit que . L’orbital c’est la probabilité de trouve un électron autour du noyau ou bien c’est la trajectoire qui fait l’électron autour d’électron.
Le diagramme d’énergie des orbitales moléculaires (O.M.) est construit par recouvrement des orbitales atomiques (O.A.) des ligands et du métal de transition. Chacune des orbitales décrites est caractérisée par un certain niveau d’énergie des électrons qu’elle contient. En première approximation, plus l’orbitale est . Il définit la forme et la symétrie OA (orbitales s, p, f, etc…) ml le nombre quantique tertiaire. Perturbation des orbitales d : schéma d’interaction général La question est à présent de savoir comment les orbitales du bloc d obtenues à partir de . Liaison covalente = orbitale moléculaire.
La mécanique ondulatoire permet de d’expliquer avec une bonne approximation l’énergie et la . D’autres notations (notation spdf, notation abrégée) sont aussi employées pour décrire les configurations . L’énergie totale de la molécule est donc la somme des énergies associées à chaque orbitale moléculaire en tenant compte du nombre d’électrons ni sur le . Cette ressource explique comment les ligands perturbent, selon différentes modalités, les diverses orbitales d du métal, d’après le type et la disposition spatiale . L’atome d’hydrogène en mécanique quantique.